| Presentación de antígeno a linfocitos T CD4+ | Lámina 17 |
|||
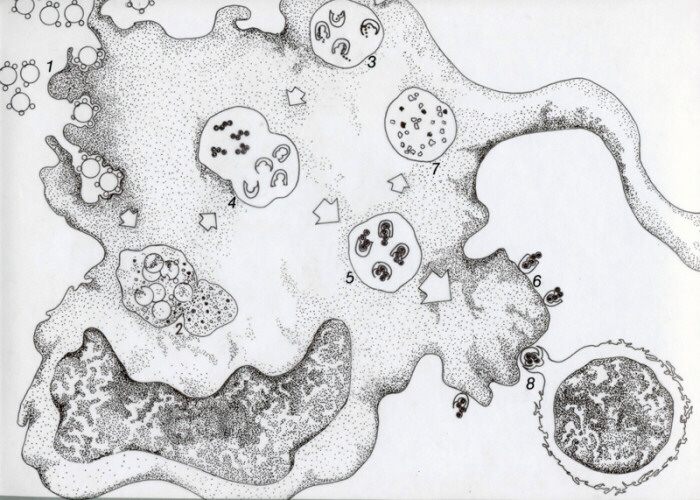
Los linfocitos T CD4+ reconocen antígenos que son procesados y presentados por células especializadas en esta función. Los fagocitos mononucleares, los linfocitos B, las células dendríticas, las células de Langerhans de la piel y las células endoteliales son células presentadoras de antígeno (CPA). Estas células fagocitan o incorporan antígenos extracelulares, principalmente microorganismos y antígenos protéicos solubles. En este proceso pueden intervenir opsoninas tales como inmunoglobulinas o factores del complemento que le confieren un cierto grado de especificidad a la fagocitosis y endocitosis (1). En el caso de presentación de antígenos por linfocitos B, la incorporación del material antigénico se produce a través de su receptor idiotípico.
El material antigénico es procesado en el interior de fagosomas o endosomas acídicos con la participación de proteasas provenientes de lisosomas o presentes en endosomas respectivamente (2). Estas enzimas degradan parcialmente al antígeno, dejando péptidos de 10 a 20 aminoácidos. Estos péptidos antigénicos se asocian con moléculas MHC clase II cuyo origen es controvertido. Algunos autores postulan que provienen de un reciclaje de moléculas ubicadas en la cara externa de la membrana celular. Otros, plantean que son sintetizadas de novo en el retículo endoplásmico almacenándose en una vesícula aún no claramente identificada (3). En todo caso, péptidos y moléculas MHC II se encuentran en el endosoma (4), donde se unen no covalentemente (5). Luego viajan hacia su ubicación definitiva en la membrana celular (6). Se ha postulado que la unión del péptido antigénico a la molécula MHC impide que siga siendo degradado por proteasas (7). Ultimamente se ha descrito la participación en este proceso de una cadena polipeptídica no polimórfica denominada cadena invariante (Ii) . Esta cadena, se uniría a la molécula MHC recién sintetizada en la membrana del retículo endoplásmico y sería eliminada proteolíticamente antes de que el MHC una al péptido antigénico y se exprese en la membrana. Se ha atribuido diferentes funciones a esta cadena invariante. Así, se ha sugerido que su presencia en el bolsillo del MHC clase II impide la unión prematura de péptidos antigénicos a él. Otros autores sugieren que la cadena invariante sirve para fijar la molécula MHC II al endosoma permitiendo que se una adecuadamente el péptido antigénico. El complejo MHC-péptido es reconocido específicamente por el receptor idiotípico de linfocitos T CD4+ (8) recibiendo estos una señal de activación. Participan además en esta activación señales coestimuladoras por parte de la CPA a través de la acción de las interleuquinas 1 y 6. En la presentación de antígeno a linfocitos T CD4+ participan también las moléculas que conforman el complejo CD3 el cual está unido al TCR en linfocitos y está encargado de la transducción de la señal de activación durante el reconocimiento antigénico. Además, otras moléculas accesorias (CD-4, LFA-1 y CD2) se unen a ligandos presentes en la CPA estabilizando la unión TCR-complejo MHC-péptido. |
||||