| Mecanismo de daño tipo II o citotóxico | Lámina 40 |
||||
Este mecanismo de daño es responsable de algunos cuadros de hipersensibilidad. Sin embargo, su participación es más importante en autoinmunidad. Los antígenos involucrados en hipersensibilidad son sustancias exógenas solubles o de origen bacteriano que se unen a a proteínas de membranas celulares o basales. También pueden ser antígenos que conforman los grupos sanguíneos en glóbulos rojos como ocurre en las reacciones post-transfusionales y en la enfermedad hemolítica del recién nacido. En autoinmunidad, los antígenos son componentes propios o endógenos que forman parte de membranas. Finalmente, el daño mediado por este mecanismo puede surgir a raíz de reacciones cruzadas entre antígenos propios y bacterianos.
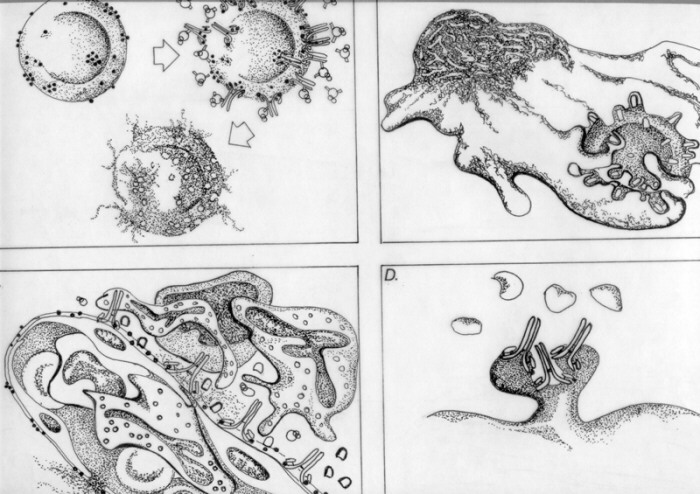
Las inmunoglobulinas que participan son la IgG y la IgM producto de respuestas primarias o secundarias ante la presencia de los antígenos mencionados. En algunos casos hay también participacion del complemento. El mecanismo de daño tipo II se presenta en cuatro modalidades: a. Lisis por complemento. El antígeno o hapteno unido a membrana o formando parte de ésta, origina una respuesta humoral tradicional de IgG e IgM. Estos anticuerpos se unen al antígeno en la membrana celular y activan al complemento por vía clásica. Se produce la lisis osmótica de la célula cuando la activación llega hasta la formación del Complejo de Ataque a Membrana (MAC). Ejemplos en hipersensibilidad: anemia hemolítica postransfusional por incompatibilidad ABO y algunos tipos de hipersensibilidad a drogas. La primera, aunque no es frecuente, es de graves consecuencias. La hemólisis es intravascular, originando hipotensión, hemoglobinuria o hemorragia difusa. Se puede llegar a un estado de shock, coagulación vascular diseminada, insuficiencia renal y a veces, la muerte. La anemia hemolítica inducida por penicilina es un ejemplo de este mecanismo de daño. Se requiere de altos títulos de IgG dirigido contra el determinante antigénico de la droga unido a la membrana celular de los glóbulos rojos. La hemólisis se inicia generalmente 7 días después de la primera exposición a la droga o después de un tiempo menor en individuos previamente sensibilizados a ella. Otras drogas tales como la quinina, quinidina y nitrofurantoína inducen anticuerpos IgG que se unen a antígenos de ciertos grupos sanguíneos tales como los sistemas Rh, Kidd, Kell y a algunas proteínas de membrana de plaquetas originando trombocitopenia. Ejemplos en autoinmunidad: neutropenia en el Lupus Eritematoso Sistémico (LES) en la cual se producen auto-anticuerpos contra estructuras de membrana de leucocitos. b. Opsonización por anticuerpos o complemento. Las inmunoglobulinas y fragmentos C3b unidos a membrana,
producen la opsonización de la célula, la
cual es fagocitada por macrófagos en bazo, ganglios
linfáticos e hígado. Se produce de esta manera
un acortamiento de la vida media de las células afectadas. Ejemplos en autoinmunidad: anemia hemolítica autoinmune presente en enfermos con Lupus Eritematoso Sistémico, donde los autoanticuerpos son IgG anti grupo sanguíneo Rh llamados anticuerpos calientes ya que interactúan con los eritrocitos del paciente a la temperatura corporal.
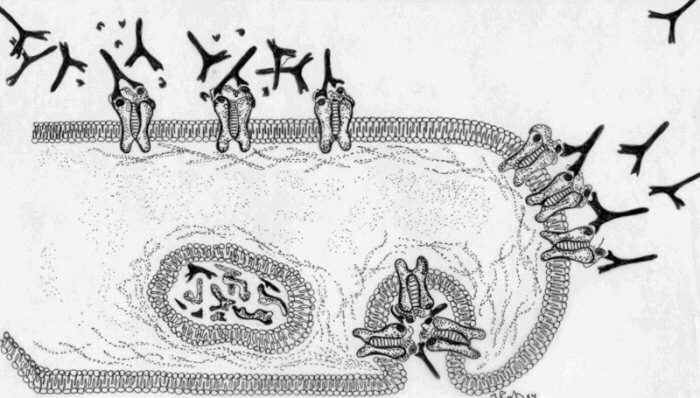
c. Inflamación en membranas basales. Cuando el antígeno se une o forma parte de membranas basales, la activación de la vía clásica del complemento por las inmunoglobulinas unidas a ellos, se traduce en una inflamación exudativa principalmente por acción de las anafilatoxinas C3a y C5a. Estas moléculas inducen la degranulación de células cebadas y basófilos liberándose mediadores químicos de la inflamación tales como histamina, leucotrienos y prostaglandinas. Una biopsia del tejido afectado incubada con anticuerpos anti-IgG o IgM fluorescentes, muestra un patrón contínuo de fluorescencia. Solo es frecuente encontrar cuadros de hipersensibilidad mediados por esta variedad de mecanismo de daño tipo II. Como ejemplo en autoinmunidad cabe mencionar al Sindrome de Goodpasture que se produce a raíz de la presencia de autoanticuerpos anti-membrana basal glomerular y pulmonar (IgG anti MBG). Su etiología es desconocida, sin embargo se ha descrito asociaciones con terapia con penicilamina, infección por el virus A2 de la influenza y exposición a solventes orgánicos. La biopsia renal y pulmonar muestra tinción fluorescente continua cuando se incuba el tejido con anticuerpos anti IgG y anti-complemento. La mayoría de los pacientes son hombres jóvenes, los que presentan neumonía hemorrágica y nefritis. Generalmente se inicia con hemoptisis, tos y disnea y continúa al cabo de unas semanas con nefritis productiva y muerte. d. Estimulación o interferencia con receptores. En algunas afecciones autoinmunes, se producen anticuerpos anti-receptores de membrana. Estos anticuerpos pueden estimular receptores mimetizando la acción de la hormona (ejemplo: Enfermedad de Basedow- Graves) o bien bloquearlos impidiendo la unión del ligando correspondiente ( ejemplo: Miastenia Gravis). En la enfermedad de Basedow-Graves se produce un hipertiroidismo con todas las consecuencias clínicas propias de esta condición. En la Miastenia Gravis se produce un debilitamiento progresivo de la actividad muscular, al no poder la acetilcolina ejercer su acción estimuladora en la placa neuromotora. Esto se puede deber por una parte a que el anticuerpo anti receptor bloquea la zona de fijación de acetilcolina en ellos. Otro mecanismo posible es la formación de enlaces cruzados entre receptores por los anticuerpos lo que se traduce en endocitosis y degradación por lisosomas de los complejos receptor-anticuerpo. Finalmente, la activación del complemento hasta C3 puede acelerar la pérdida de receptores y hasta C9 destruir la membrana post-sináptica. Algunos autores incluyen también en este mecanismo de daño inmunológico a la actividad ADCC de células NK. |
|||||